MassenwirkungsgesetzAlle reversiblen chemischen Reaktionen laufen unvollständig ab, d.h. es liegt immer eine gewisse Menge der Edukte und der Produkte vor. Das Massenwirkungsgesetz beschreibt die Lage des Gleichgewichtes. Man unterscheidet die Gleichgewichtskonstanten 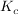 und und 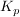 . .
Die Gleichgewichtskonstante Kc
Die Gleichgewichtskonstante 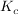 beschreibt die Lage des Gleichgewichtes über die Konzentrationen im Gleichgewicht. beschreibt die Lage des Gleichgewichtes über die Konzentrationen im Gleichgewicht.

Für eine Reaktion der Form
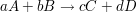
berechnet sich die Gleichgewichtskonstante 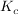 zu zu
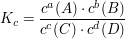
Die Gleichgewichtskonstante Kp
Die Gleichgewichtskonstante 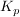 beschreibt die Lage des Gleichgewichtes über die Partialdrücke von Gasen im Gleichgewicht. beschreibt die Lage des Gleichgewichtes über die Partialdrücke von Gasen im Gleichgewicht.
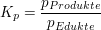
Für eine Reaktion der Form
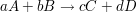
berechnet sich die Gleichgewichtskonstante 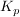 zu zu

Der Zusammenhang von Kc und Kp
Aus dem idealen Gasgesetz
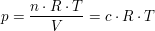
und der Gleichung

folgt
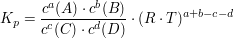
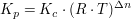
Die Lage des Gleichgewichtes
Die (ungefähre) Lage des Gleichgewichtes kann an der Gleichgewichtskonstanten K abgelesen werden. Hierzu können zwei Fälle unterschieden werden:
- K >> 1 Das Gleichgewicht liegt deutlich auf Seiten der Produkte.
- K << 1 Das Gleichgewicht liegt deutlich auf Seiten der Edukte.
Zurück
MatheBank - PhysikBank - ChemieBank - AllgemeineChemie
|